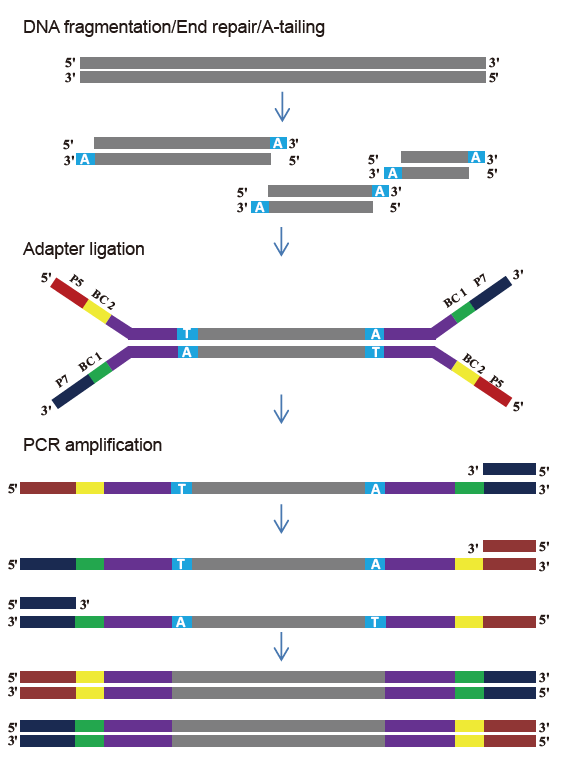
Комплет за библиотека TIANSeq DirectFast (илумина)
Карактеристики
■ Добра униформност на секвенционирање: Без пристрасност кон процесот на фрагментација на ДНК и процес на засилување на ПЦР.
■ Висока ефикасност на конверзија на библиотека: библиотечната конструкција со висока ефикасност може да се обезбеди за примероци од 1 ng ДНК.
■ Брзо работење: На целиот процес на изградба на библиотека му требаат само 2,5 часа.
■ Економично: Не се потребни специјални инструменти и опрема。
Спецификација
Тип: Подготовка на библиотека на ДНК за платформа за секвенционирање со висока моќност на илумина
Пример: Геномска ДНК или ДНК на голем фрагмент
Цел: Дво-верижна ДНК
Започнување внесување примерок: 1 ng- 1 μg
Време на работа: 2,5 часа
Апликации низводно: Редоследување на платформата за илумина
Сите производи може да се прилагодат за ODM/OEM. За детали,кликнете на Приспособена услуга (ODM/OEM)
Флексибилен внес на примерок и фрагментирана големина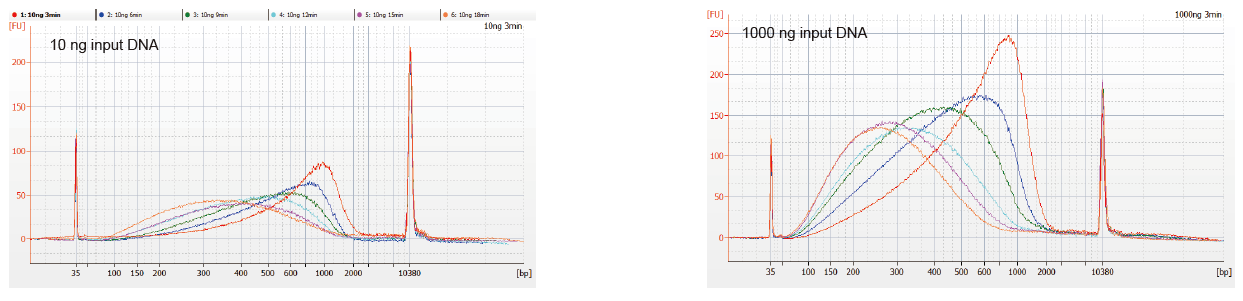 |
Слика 1. Профили на фрагментација на ДНК со различно време на реакција. 10 ng и 1000 ng ДНК беа фрагментирани со помош на TIANSeq DirectFast DNA Library Kit. Производите за реакција третирани со различно време на реакција беа прочистени со магнетни зрнца 1,8 × Ампур XP и анализирани со Angilent 2100. |
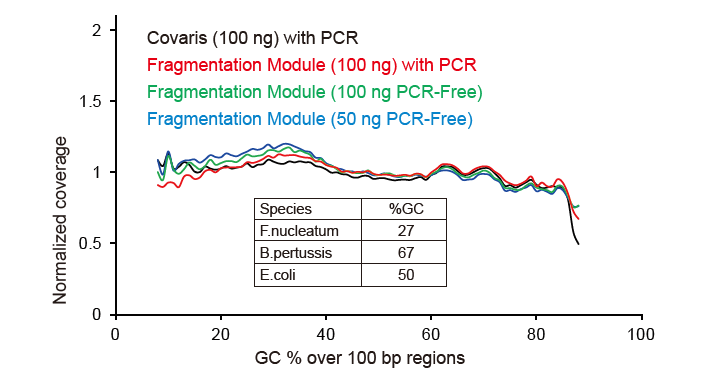
Покривање на секвенци слично на Коварис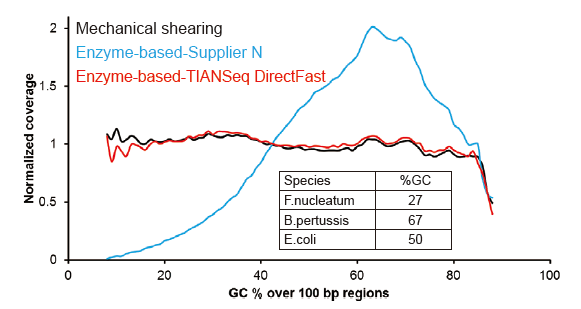 |
Слика 2. Споредба на опфаќањето на геномот на различни методи за подготовка на библиотека. Три бактериска геномска ДНК со различна содржина на GC се мешаат еквимоларно, и се споредуваат резултатите од опфаќањето на геномот од 100 ng мешани библиотеки на ДНК со помош на овие методи. Резултатите покажуваат дека библиотечниот комплет TIANSeq DirectFast има ист ефект врз фрагментацијата на ДНК како и механичкото стрижење, и нема основна пристрасност за фрагментација. |
Нема систематска пристрасност за ниско ниво од 1 ng влезна ДНК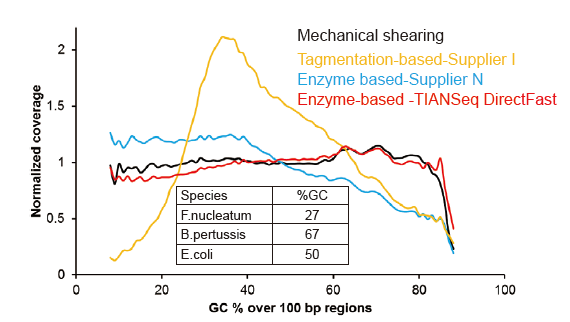 |
Слика 3. Споредба на опфаќањето на геномот на различни методи за подготовка на библиотека. Три бактериска геномска ДНК со различна содржина на GC се мешаат еквимоларно, и се споредуваат резултатите од опфаќањето на геномот од 1 ng мешани библиотеки на ДНК со помош на овие методи. Резултатите покажуваат дека библиотечниот комплет TIANSeq DirectFast има конзистентен ефект на фрагментација со механичкото стрижење дури и за влез на ДНК до 1 ng, и нема базна пристрасност. |
| Способен за работен тек без PCR
|
Слика 4. Различен влез на геномска ДНК се користеше за изградба на библиотеката со помош на конструкција на библиотека без ПЦР или ПЦР, и резултатите од геномната покриеност беа споредувани. Резултатите покажуваат дека со работа со една цевка и ефикасни чекори за изградба на библиотека, библиотеката на ДНК, изградена со библиотечниот комплет TIANSeq DirectFast, одржува висока конзистентност со механичкото смолкнување во распределбата на опсегот на фрагменти за двата збогатени PCR работни процеси, збогатени со PCR. |
Статистика за ефикасност и принос на изградба на библиотеки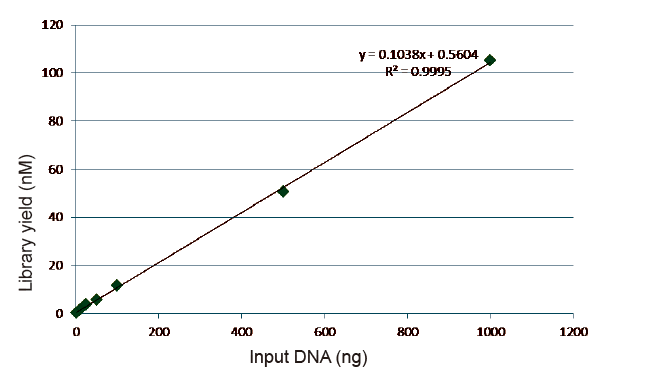 |
Слика 5. Резултати од квантитативна анализа на библиотечна ДНК добиена со qPCR по конструкција на библиотека со метод без PCR за примероци со различни почетни количини (1, 10, 25, 50, 100, 500.1000 ng). Анализата на линеарна регресија покажува дека приносот на библиотеката има добра линеарна врска во широк опсег на влезни примероци. За влез на ДНК до 1 ng, ефикасноста на конструкцијата на библиотеката не се намалува. |
Споредба на секвенционирање податоци за различни производи
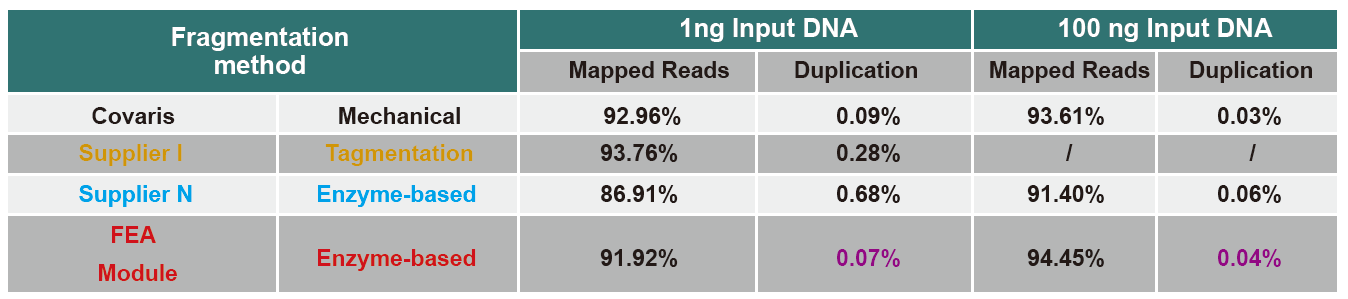
Во моментов, технологијата за секвенционирање со висок проток главно се заснова на технологија за секвенционирање на следната генерација. Бидејќи должината на читање на технологијата за секвенционирање на следната генерација е ограничена, ние мора да ја поделиме секвенцата со целосна должина во библиотеки со мали фрагменти за да ги распоредиме. Според потребите на различни експерименти за секвенционирање, ние обично избираме секвенционирање со еден крај или секвенционирање со двојно завршување. Во моментов, фрагментите на ДНК од библиотеката за секвенционирање на следната генерација се генерално дистрибуирани во опсег од 200-800 р.

а) ДНК е слаб по квалитет и содржи инхибитори. Користете висококвалитетни примероци на ДНК за да избегнете инхибиција на ензимската активност.
б) Количината на примерок од ДНК е недоволна кога се користи метод без PCR за изградба на ДНК библиотека. Кога влезот на фрагментираната ДНК надминува 50 ng, работниот тек без PCR може селективно да се спроведе за време на изградбата на библиотеката. Ако бројот на копии на библиотеката е премногу низок за да биде директно секвенциониран, библиотеката на ДНК може да се засили со ПЦР по лигатурата на адаптерот.
в) контаминација со РНК доведува до неточна почетна квантификација на ДНК Контаминација на РНК може да постои во процесот на прочистување на геномската ДНК, што може да доведе до неточна квантификација на ДНК и недоволно оптоварување на ДНК за време на изградбата на библиотеката. РНК може да се отстрани со третман со РНазе.
А-1
а) Се појавуваат мали фрагменти (60 bp-120 bp) Малите фрагменти обично се адаптерски фрагменти или димери формирани од адаптери. Прочистувањето со магнетни зрнца Agencourt AMPure XP може ефикасно да ги отстрани овие фрагменти од адаптерот и да обезбеди квалитет на секвенционирање.
б) Големи фрагменти се појавуваат во библиотеката по засилување на ПЦР Големината на фрагментот на библиотечната ДНК ќе се зголеми за 120 п.п. откако ќе се поврзе адаптерот. Ако фрагментот на ДНК се зголеми за повеќе од 120 точки по лигатурата на адаптерот, може да биде предизвикан од абнормално засилување на фрагментот од прекумерно засилување на ПЦР. Намалувањето на бројот на PCR циклуси може да ја спречи ситуацијата.
в) Абнормална големина на фрагменти од ДНК на библиотека по лигатура на адаптер Должината на адаптерот во овој комплет е 60 р. Кога двата краја на фрагментот се врзуваат за адаптерите, должината ќе се зголеми само за 120 п.п. Кога користите адаптер различен од оној што е предвиден со овој комплет, ве молиме контактирајте со добавувачот за да ги дадете релевантните информации, како што е должината на адаптерот. Ве молиме, осигурајте се дека работниот тек и работата на експериментот следете ги чекорите опишани во упатството.
г) Абнормална големина на фрагментот на ДНК пред поврзување на адаптерот Причината за овој проблем може да биде предизвикана од погрешни услови на реакција за време на фрагментацијата на ДНК. Треба да се користат различни времиња на реакција за различен влез на ДНК. Ако влезот на ДНК е повеќе од 10 ng, препорачуваме да го одберете времето на реакција од 12 мин како почетно време за оптимизација, а големината на фрагментот произведена во тоа време е главно во опсег од 300-500 bp. Корисниците можат да ја зголемат или намалат должината на фрагментите на ДНК за 2-4 минути според нивните сопствени барања за да ги оптимизираат фрагментите на ДНК со потребната големина.
А-2
а) Времето на фрагментација не е оптимизирано Ако фрагментираната ДНК е премногу мала или премногу голема, ве молиме погледнете ги Упатствата за избор на време на фрагментација дадени во упатството за да го одредите времето на реакција и користете ја оваа временска точка како контрола, дополнително поставете систем за реакција за да се продолжи или скрати 3 мин за да се направи попрецизно прилагодување на времето на фрагментација.
А-3
Абнормална дистрибуција на ДНК по големина по третманот со фрагментација
а) Неточен метод на одмрзнување на реагенсот за фрагментација, или реагенсот не е целосно измешан по одмрзнувањето. Одмрзнете го реагенсот за фрагментација на фракментот 5 Mix на мраз. Откако ќе се одмрзне, измешајте го реагенсот рамномерно со нежно трепкање на дното на цевката. Не го вртете реагенсот!
б) Внесниот примерок од ДНК содржи ЕДТА или други загадувачи Исцрпувањето на јони на сол и хелатни агенси во чекорот на прочистување на ДНК е особено важно за успехот на експериментот. Ако ДНК е растворена во 1 × ТЕ, користете го методот даден во упатството за да извршите фрагментација. Ако концентрацијата на ЕДТА во растворот е неизвесна, се препорачува да се прочисти ДНК и да се раствори во деионизирана вода за последователна реакција.
в) Неточна почетна квантификација на ДНК Големината на фрагментираната ДНК е тесно поврзана со количината на внесената ДНК. Пред третманот со фрагментација, точната квантификација на ДНК користејќи Qubit, Picogreen и други методи е од суштинско значење за да се одреди точната количина на ДНК во реакциониот систем.
г) Подготовката на системот за реакција не ги следи упатствата Подготовката на фрагментиран систем за реакција мора да се спроведе на мраз строго според упатствата. За да се обезбеди најдобар ефект, сите компоненти на реакцијата треба да се стават на мраз и подготовката на системот за реакција треба да се изврши по целосно ладење. Откако ќе заврши подготовката, ве молиме потчукнете или пипетирајте темелно да се измешаат. Не вртете вител!
1. Несоодветен метод на мешање (вител, насилна осцилација, итн.) Ќе предизвика абнормална распределба на фрагментите од библиотеката (како што е прикажано на следната слика), со што ќе влијае на квалитетот на библиотеката. Затоа, при подготвување на реакциониот раствор за фрагментација микс, ве молиме нежно пипетирајте горе и долу за да се измеша, или користете го прстот за да трепкате и измешате рамномерно. Внимавајте да не се измешате со вител.

2. ДНК со висока чистота мора да се користи за изградба на библиотека
■ Добар ДНК интегритет: Електрофорезната лента е повеќе од 30 kb, без опашка
■ OD260/230:> 1,5
OD260/280: 1,7-1,9
3. Внесниот износ на ДНК мора да биде точен Се предлага да се користат Qubit и PicoGreen методи за квантитативна ДНК, наместо Нанодроп.
4. Содржината на ЕДТА во ДНК растворот мора да се определи ЕДТА има големо влијание врз реакцијата на фрагментација. Ако содржината на ЕДТА е висока, потребно е да се изврши прочистување на ДНК пред последователниот тест.
5. Решението за реакција на фрагментација мора да се подготви на мраз Процесот на фрагментација е чувствителен на температурата и времето на реакцијата (особено по додавање на засилувач). Со цел да се осигура точноста на времето на реакција, ве молиме подгответе го системот за реакција на мраз.
6. Времето на реакција на фрагментација мора да биде точно Времето на реакција на чекорот на фрагментација директно ќе влијае на големината на производите од фрагментот, со што ќе влијае на дистрибуцијата на големината на фрагментите на ДНК во библиотеката.
1. Каков тип на примерок се применува за овој комплет?
Применлив тип примерок од овој комплет може да биде вкупна РНК или прочистена иРНК со добар интегритет на РНК. Ако вкупната РНК се користи за конструирање на библиотеката, се препорачува да се користи комплетот за осиромашување на rRNA (Cat#4992363/4992364/4992391) за прво отстранување на rRNA.
2. Дали може примероците од FFPE да се користат за изградба на библиотека со овој комплет?
МРНК во примероците на FFPE ќе биде деградирана до одреден степен, со релативно слаб интегритет. Кога го користите овој комплет за изградба на библиотека, се препорачува да се оптимизира времето на фрагментација (скратете го времето на фрагментација или не изведувајќи фрагментација).
3. Користејќи го чекорот за избор на големина наведен во упатството за производот, што може да предизвика мало отстапување на вметнатиот сегмент?
Изборот на големина треба да се изврши во строга согласност со чекорот за избор на големина во овој прирачник за производ. Ако има отстапување, причината може да биде тоа што магнетните зрнца не се балансирани до собна температура или не се целосно измешани, пипетата не е точна или течноста останува во врвот. Се препорачува да се користат совети со мала адсорпција за експериментот.
4. Избор на адаптери во библиотечната конструкција
Комплетот за конструкција на библиотека не содржи реагенс за адаптер и се препорачува да го користите овој комплет заедно со адаптерот за еден индекс TIANSeq (Илумина) (4992641/4992642/4992378).
5. КК на библиотеката
Библиотечна квантитативна детекција: Qubit и qPCR се користат за одредување на концентрацијата на маса и моларна концентрација на библиотеката, соодветно. Работата е строго во согласност со упатството за производот. Концентрацијата на библиотеката генерално ќе ги исполни барањата за секвенционирање на НГС. Откривање на опсег на дистрибуција на библиотека: Користење на Agilent 2100 Bioanalyzer за откривање на дистрибутивниот опсег на библиотека.
6. Избор на број на циклус на засилување
Според инструкциите, бројот на ПЦР циклуси е 6-12, а бројот на потребни ПЦР циклуси треба да се избере според внесот на примерокот. Во библиотеките со висок принос, прекумерното засилување обично се случува во различни степени, што се манифестира со малку поголем врв по врвот на целниот опсег при откривање на Agilent 2100 Bioanalyzer, или откриената концентрација на Qubit е помала од онаа на qPCR. Благото прекумерно засилување е нормален феномен, кој не влијае на секвенционирањето на библиотеката и последователната анализа на податоците.
7. Спајкс се појавува во профилот за откривање на Agilent 2100 Bioanalyzer
Појавата на боцки при откривање на Биоанализатор Agilent 2100 се должи на нерамномерната фрагментација на примероците, каде што ќе има повеќе фрагменти во одредена големина, и тоа ќе стане поочигледно по збогатувањето на ПЦР. Во овој случај, се предлага да не се изврши избор на големина, односно да се постави состојбата на фрагментација на 94 ° C за 15 минути инкубирана, каде распределбата на фрагментот е мала и концентрирана, а хомогеноста може да се подобри.
Категории на производи
ЗОШТО НЕ ИЗБЕРЕМЕ
Од своето основање, нашата фабрика развива производи од прва светска класа со почитување на принципот
со квалитет прво. Нашите производи се здобија со одлична репутација во индустријата и вредна доверба меѓу новите и старите клиенти.