Комплет FastKing Еден чекор RT-PCR
Карактеристики
■ Чистота: Обратната транскрипција и реакциите на ПЦР се завршуваат во еден чекор за да се избегне вкрстена контаминација.
■ Висока ефикасност: Единствена обратна транскриптаза на King со RT ефикасност над 95%.
■ Чувствително: Шаблони до 1 ng може точно да се идентификуваат, особено за шаблони со мало изобилство.
■ Специфичност: Так полимеразата модифицирана со антитела дополнително ја подобрува ефикасноста и специфичноста на засилување.
Апликации
Таа е погодна за откривање на нивото на генска експресија во клетките и ткивата, клонирање на cDNA на специфични гени и откривање на РНК вирус. Особено е погоден за квалитативно откривање на шаблони со мало изобилство.
Сите производи може да се прилагодат за ODM/OEM. За детали,кликнете на Приспособена услуга (ODM/OEM)
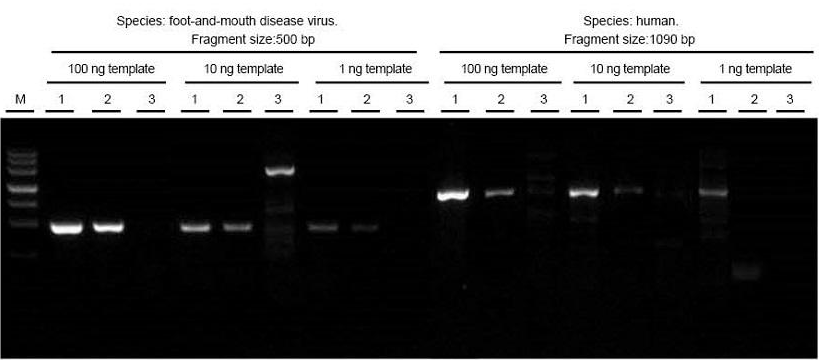 |
Вкупно, РНК на вирусот на лигавка и шап и примероци од човечко ткиво беа извлечени соодветно. Обратен транскрипт и PCR целните фрагменти со различна должина користејќи TIANGEN FastKing One Step RT-PCR комплет (1), релевантни производи од Добавувачот А (2) и Добавувачот Б (3) и наб observeудувајте ПЦР производи по електрофореза. Резултатите покажуваат дека опсегот на FastKing One Step RT-PCR Kit е јасен и светол, без опашки и неспецифични опсези, а шаблонот 1 ng може добро да се открие. Експерименталните резултати на TIANGEN се подобри од оние на релевантните производи. |
А-1 РНК е деградирана
—— Прочистете висококвалитетна РНК без контаминација. Материјалот од кој е извлечена РНК треба да биде што е можно посвеж за да се спречи деградација на РНК. Анализирајте го интегритетот на РНК на денатуриран гел пред реакција на РТ. По екстракција на РНК, треба да се чува во 100% формамид. Ако се користи инхибитор на RNase, температурата на греењето треба да биде <45 ° C, а pH вредноста треба да биде помала од 8,0, инаку инхибиторот ќе ја ослободи целата поврзана RNase. Покрај тоа, инхибиторот на RNase треба да се додаде во раствори што содржат ≥ 0,8 mM DTT.
РНК А-2 содржи инхибитори на реакции на обратна транскрипција
—— Обратните транскрипциони инхибитори вклучуваат СДС, ЕДТА, глицерол, натриум пирофосфат, спермидин, формамид, гуанидинска сол, итн. Измешајте ја контролната РНК со примерокот и споредете го приносот со контролната РНК реакција за да проверите дали постои инхибитор. Времето на РНК се мие со 70% (v/v) етанол за да се отстранат инхибиторите.
А-3 Недоволно огревање на прајмери што се користат за синтетизирање на првата низа на cDNA
——Определете дека температурата на огнот е соодветна за прајмерите што се користат во експериментот. За случајни хексамери, се препорачува да се одржува температурата на 25 ° C 10 минути пред да се достигне температурата на реакцијата. За прајмери специфични за гени (GSP), обидете се со други GSP или префрлете се на oligo (dT) или случаен хексамер.
А-4 Мала количина на почетна РНК
- Зголемете ја количината на РНК. За примероци на РНК помали од 50 ng, 0,1 μg до 0,5 μg ацетил BSA може да се користат во првата синтеза на cDNA синџир
A-5 Целната секвенца не е изразена во анализираните ткива.
--— Обидете се со други ткива.
А-6 ПЦР реакцијата не успее
——За два чекора RT-PCR, шаблонот cDNA во чекорот PCR не може да надмине 1/5 од волуменот на реакцијата.
А-1 Неспецифично загревање на прајмери и шаблони
—— Крајот 3’ на прајмерите не треба да содржи 2-3 dG или dC. Користете прајмери специфични за Ген во првата синтеза на влакно, наместо случајни прајмери или олиго (dT). Користете повисока температура на огнување во првите неколку циклуси, а потоа и пониска температура на огнување. Користете Taq DNA-полимераза со топол почеток за PCR за да ја подобрите специфичноста на реакцијата.
А-2 Лош дизајн на прајмери специфични за гени
- Следете ги истите принципи за дизајн на буквар за засилување.
РНК А-3 контаминирана со геномска ДНК
--Третирајте РНК со PCR-одделение DNase I. Поставете контролна реакција без обратна транскрипција за да откриете контаминација на ДНК.
А-4 Формирање на прајмер димер
—— Дизајнирајте буквари без комплементарни секвенци на крајот од 3 ’.
А-5 Превисок Mg2+ концентрација
--— Оптимизирајте го Mg2+ концентрација за секоја комбинација шаблон и прајмер
А-6 Контаминиран со туѓа ДНК
—— Користете совети отпорни на аеросол и ензими UDG.
А-1 Содржината на производот од првата насока е превисока
- Намалете ја количината на производот од првата насока во конвенционалниот чекор на реакција на ПЦР.
А-2 Премногу висока количина на прајмер во реакцијата на ПЦР
—— Намалете го внесот на прајмер.
А-3 Премногу циклуси
—— Оптимизирајте ги условите за реакција на ПЦР и намалете го бројот на циклусот на ПЦР.
А-4 Премногу ниска температура на огнување
—— Зголемете ја температурата за огревање за да спречите неспецифично започнување и продолжување.
А-5 Неспецифично засилување на фрагменти од олигонуклеотид генерирано од деградација на ДНК на ДНАза--Извлечете висококвалитетна РНК за да спречите контаминација на ДНК.
РТ-ПЦР треба да направи обратна транскрипција на РНК во cDNA, а потоа да користи обратна транскрибирана cDNA како образец за PCR реакција за да го засили целниот фрагмент. Изберете или случајни прајмери, Олиго дТ и гени специфични прајмери според специфичните услови на експериментот. Сите горенаведени прајмери може да се користат за кратка еукариотска клеточна mRNA без структура на фиба.
Случаен прајмер: Погоден за долга РНК со структура на фиба, како и за сите видови РНК како што се рРНК, иРНК, тРНК, итн. Тие главно се користат за реакција на РТ-ПЦР на единечен образец.
Олиго дТ: Погоден за РНК со ПолиА опашка (прокариотска РНК, еукариотска Олиго дТ рРНК и тРНК немаат ПолиА опашки). Бидејќи Oligo dT е врзан за PolyA опашка, квалитетот на примероците на РНК се бара да биде висок, па дури и мала количина на деградација во голема мера ќе го намали количеството на целосна синтеза на cDNA.
Буквар специфичен за ген: Дополнителен со низата шаблони, погоден за ситуации каде што целната секвенца е позната.
Постојат два начина:
1. Внатрешен референтен метод: Во теорија, cDNA е фрагменти од ДНК со различна должина, така што резултатот од електрофорезата е размаска. Ако изобилството на РНК е ниско, ниту еден производ нема да се прикаже во електрофореза, но тоа не значи дека ниеден производ нема да се засили со ПЦР. Општо земено, внатрешната референца може да се користи за откривање на cDNA. Ако внатрешната референца има резултати, квалитетот на cDNA во основа може да се гарантира (во неколку случаи, ако фрагментот на целниот ген е премногу долг, може да има исклучоци).
2. Ако постои познат ген засилен со овој образец, може да се потврди со прајмерите на овој ген. Засилувањето на внатрешната референца не мора да значи дека нема проблем со cDNA. Бидејќи внатрешната референца има големо изобилство во cDNA, лесно е да се засили. Ако cDNA е делумно деградиран од различни причини, од перспектива на веројатност, резултатите од PCR на целните гени со ниско изобилство ќе бидат многу засегнати. Иако внатрешната референца е с high уште висока во изобилство, засилувањето веројатно нема да биде засегнато.
Делумно се распаѓа РНК. Откријте го интегритетот и прочистете ја РНК
Содржината на РНК на различни видови може да биде различна, но генерално, извлечената вкупна РНК треба да содржи две јасни ленти 28S и 18S во гел електрофореза, а осветленоста на поранешниот опсег треба да биде двојно повисока од онаа на вториот. Бендот 5S покажува дека РНК е деградирана, а нејзината осветленост е пропорционална со степенот на деградација. Успешното засилување на внатрешната референца не значи дека нема проблем со РНК, бидејќи внатрешната референца е во голема количина, РНК може да се засили се додека деградацијата не е сериозна. ОД260/ОД280соодносот на чистата РНК измерена со спектрофотометар треба да биде помеѓу 1,9 и 2,1. Мала количина протеинска нечистотија во РНК ќе го намали односот. С the додека вредноста не е премногу ниска, RT нема да биде засегнат. Она што е најважно за РТ е интегритетот на РНК.
Проширувањето на внатрешниот референтен ген може само да покаже дека RT успеа, но тоа не е нужно поврзано со квалитетот на cDNA низата. Бидејќи внатрешните референтни фрагменти се генерално мали по големина и високи во изразот, полесно е да бидат успешни во обратна транскрипција. Сепак, големината и изразот на целниот ген варира од ген до ген. Квалитетот на cDNA не може да се процени само со внатрешна референца, особено за целните фрагменти подолги од 2 kb.
Некои примероци имаат сложени секундарни структури, или имаат богата содржина на ГК, или се скапоцени со мало изобилство. Во овие случаи, соодветна обратна транскриптаза треба да биде избрана според големината на целниот фрагмент и примерокот. За шаблони за РНК со висока содржина на ГК и сложена секундарна структура, тешко е да се отвори секундарната структура на ниска температура, или со заедничка обратна транскриптаза. За овие шаблони, може да се избере Quant Reverse Transcriptase, бидејќи неговата обратна транскрипција перформанси е очигледно подобра од онаа на M-MLV серијата за обратна транскриптаза, која може да преобрази транскрипција на различни RNA шаблони ефикасно и да препише RNA во cDNA првата нишка до максимална мера. Кога се користи општ комплет за обратна транскриптаза, 20 μl систем може само ефективно да обратна транскрипција на 1 μg од вкупната РНК. Ве молиме обрнете внимание на максималниот капацитет за RT на комплетот. Ако образецот е додаден во вишок, обратната транскрипција ќе ја фаворизира РНК со големо изобилство. Затоа, подобро е да не го надминувате максималниот капацитет на системот.
А-1 Определете дали РНК е сериозно деградирана и дали РТ е успешна
Во принцип, причината за неуспехот на внатрешната референтна засилување често е предизвикана од сериозна деградација на РНК. Друга можна причина е неуспехот на обратна транскрипција. Внатрешната референца не може да се користи како стандард за да се процени квалитетот на единечната жица на cDNA, но може да се користи како стандард за да се процени дали обратната транскрипција е успешна ако нема проблем со квалитетот на РНК. Најважно во процесот на обратна транскрипција е да се одржува константна температура и систем за постојана реакција со цел да се подобри ефикасноста на реакцијата.
А-2 Определете дали прајмерите за засилување на внатрешните референтни гени се сигурни и дали има проблеми со реагенсите што се користат во ПЦР.
За релативна квантификација, РНК мора да се квантифицира пред обратна транскрипција, што исто така е потребно во многу комплети за обратна транскрипција, на пример, квантифицирајте го влезот на РНК како 1 μg. Бидејќи обратно транскрибираната cDNA е мешан раствор, вклучувајќи РНК, олиго dT, ензим, dNTP, па дури и малку остатоци од ДНК, ќе се предизвика отстапување, па затоа е невозможно точно да се измери cDNA. Затоа, неопходна е квантификација на РНК. Имајќи предвид дека ефикасноста на обратна транскрипција е иста кај различни примероци, количината на добиената cDNA треба да биде иста, а квантитативната анализа може да покаже споредба на нивоата на експресија на различни гени во иста количина на вкупна РНК. При изведување на релативна флуоресцентна квантитативна PCR, квантитативна cDNA не може да биде потребна по обратна транскрипција, бидејќи внатрешниот референтен ген може да дејствува како референца.
Главно е поврзано со гените, а обратната транскрипција на долг фрагмент не е изводлива за повеќето гени. Прво, ефикасноста на обратна транскрипција е далеку помала од онаа на ПЦР. Второ, регионот богат со ГК и секундарната структура на многу гени ја ограничуваат обратната транскрипција и ПЦР. Конечно, верноста и ефикасноста на засилување на ПЦР е тешко да се гарантираат во исто време. Во процесот на обратна транскрипција, никој не може да гарантира дека ќе добие долг фрагмент за гени со мала копија, особено со употреба на олиго дТ. Што се однесува до 5 'UTR со повеќе GC, тоа е уште потешко. Затоа, с still уште е разумен метод да се преиначи транскриптот со случајни прајмери, да се пронајдат природните места на расцепување во целниот фрагмент, да се засилат со сегменти, а потоа да се изврши ограничување на варење и лигатура. Во принцип, тешко е директно да се засилат фрагменти поголеми од 2 kb, но не е секогаш невозможно да се добијат: 1. Прво на сите, гарантирајте го интегритетот на РНК/mRNA, и се претпочита екстракција со ТРИЗОЛ. 2. Комплетот M-MLV RT-PCR може директно да се користи. Продолжете го времето на огнување и правилно зголемете го бројот на циклусот во процесот на засилување. Алтернативно, вгнездена ПЦР може да се примени или да спроведе една или две реакции прво со соодветно продолжено време на денатурација и продолжување пред нормалното засилување на ПЦР, што може да помогне во продолжувањето на фрагментите. Обрнете внимание на верноста на полимеразата. 3.Long Taq може да се користи во PCR за да се добијат идеални резултати. 4. За примена на протеински израз, треба да се примени полимераза со голема верност.
Постојат два вида обратна транскриптаза понудени од TIANGEN: Quant/King RTase и TIANScript M-MLV. Главната разлика помеѓу нив е влезната количина шаблони. Quant е уникатна обратна транскриптаза, која е различна од најчесто користениот M-MLV, добиен од вирусот на леукемија кај Молини. Quant е нова реверзибилна транскриптаза со висока ефикасност, која е рекомбинантно изразена со инженерска ешерихија коли. Quant е погоден за засилување на 50 ng-2 μg РНК со висока обратна транскрипциона активност и висок принос. Во споредба со обичните ММЛВ или АМВ, најголемата карактеристика на Квант е тоа што има многу силен афинитет со шаблоните за РНК и може да ги смени сложените шаблони за транскрипција без денатурација на висока температура. За шаблони со повисока содржина на GC, обратната ефикасност е поголема. Сепак, оваа обратна транскриптаза има активност на RNase H, што може да влијае на должината на производот cDNA (погоден за шаблони <4,5 kb). За конвенционална обратна транскрипција, се препорачува обратна транскриптаза TIANScript MMLV. Овој RTase е модифициран ензим со многу слаба активност на RNase H, кој е погоден за долга (> 5 kb) синтеза на cDNA.
Обратна транскрипција во еден чекор и засилување на PCR се завршуваат во иста цевка без да се отвори капакот на цевката помеѓу синтезата и засилувањето на cDNA, што е корисно за намалување на контаминацијата. Бидејќи сите примероци од cDNA добиени се користат за засилување, чувствителноста е поголема, со минимум 0,01 pg од вкупната РНК. За успешен едностепен RTPCR, ген-специфични прајмери обично се користат за иницирање на синтеза на cDNA. Методот во два чекори, имено обратна транскрипција и засилување на ПЦР се изведува во два чекори. Прво, обратна транскрипција се изведува од образец на РНК за да се добие cDNA, а добиената cDNA е подложена на една или повеќе различни PCR реакции. Методот во два чекори може да користи олиго (dT) или случајни прајмери за да ја води синтезата на првото влакно на cDNA, и може обратно да ги транскрибира сите информации за mRNA од специфичен примерок.
Категории на производи
ЗОШТО НЕ ИЗБЕРЕМЕ
Од своето основање, нашата фабрика развива производи од прва светска класа со почитување на принципот
со квалитет прво. Нашите производи се здобија со одлична репутација во индустријата и вредна доверба меѓу новите и старите клиенти.