TIANcombi DNA Lyse & Det PCR комплет
Карактеристики
■ Едноставно и брзо: ДНК од различни ткива може да се извлече за 5 мин без потреба од мелење течен азот.
■ Широки апликации: Применливи за лисја од растенија, семиња, животински ткива, примероци од крв (свежа крв, антикоагулација, згрутчување на крвта, исушени дамки од крв, итн.), Квасец и бактерии.
■ Силна компатибилност: PCR реагенсот е соодветен за засилување на ДНК извлечена од различни извори на примероци.
Апликации
■ Откривање на гени: Идеален избор за детекција на гени од големи размери.
Важни белешки
■ За примероци кои содржат високо ниво на феноли, како што се лисјата од памук, количината на примерок од примерокот треба строго да биде помала од 0,4 mg, инаку PCR реакцијата ќе биде засегната.
Сите производи може да се прилагодат за ODM/OEM. За детали,кликнете на Приспособена услуга (ODM/OEM)
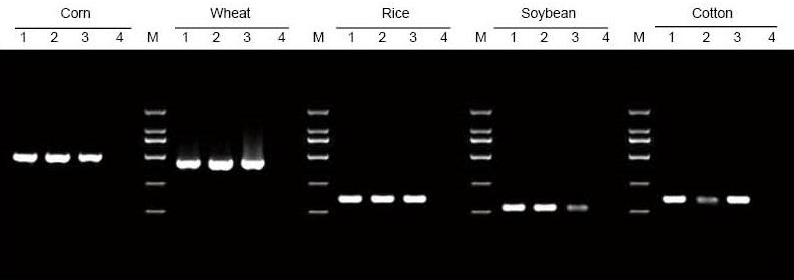 |
ДНК беше извлечена од 5 мг лисја и семиња од пченка, пченица, ориз, соја и памук, соодветно. ДНК беше засилена со ПЦР користејќи специфични прајмери. 6 μl ДНК од вкупните 20 μl елуенти беа вчитани по лента. 1: Геном за позитивна контрола; 2: оставете примероци; 3: примероци од семе; 4: НТЦ; 5: D2000 прајмери |
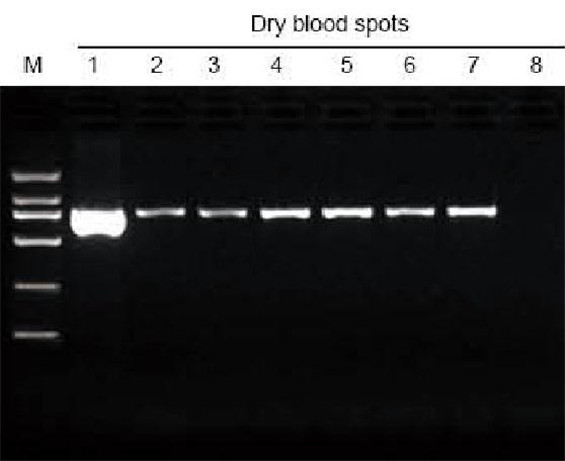 |
М: TIANGEN Маркер D2000; 1: Позитивна контрола; 2-7: Бројот на исушени крвни дамки на филтер-хартијата е 1-6 соодветно; 8: Негативна контрола. Пробивачот од 3 мм беше искористен за да се земат исушените дамки од крв од филтер -хартијата како материјал за тестот за екстракција. 6 μl ДНК од вкупните 20 μl елуенти беа вчитани по лента. |
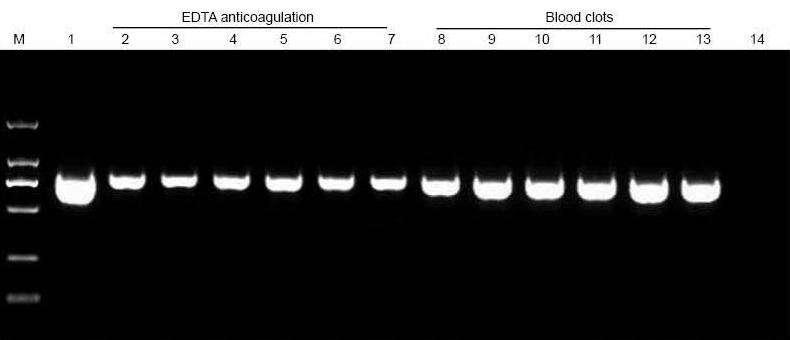 |
М: TIANGEN Маркер D2000; 1: Позитивна контрола (геномска ДНК се користеше како образец); 2-7: Количината на додадена крв е 10 μl, 20 μl, 30 μl, 40 μl, 50 μl и 60 μl, соодветно; 8-13: Количината на додадена крв е 10 μl, 20 μl, 30 μl, 40 μl, 50 μl и 60 μl, соодветно; 14: НТЦ. 6 μl ДНК од вкупните 20 μl елуенти беа натоварени на агарозен гел. |
Шаблон А-1
■ Шаблонот содржи нечистотии од протеини или инхибитори на Taq, итн. —— Прочистете го образецот на ДНК, отстранете ги нечистотиите од протеините или извлечете ДНК на шаблонот со комплети за прочистување.
■ Денатурацијата на шаблонот не е целосна —— Соодветно зголемување на температурата на денатурација и продолжување на времето на денатурација.
Deg Деградација на шаблон-—Подгответе го образецот.
А-2 Буквар
Or Лош квалитет на прајмери-—По-синтетизирајте го прајмерот.
Deg Деградација на прајмер —— Поделете ги прајмерите со висока концентрација во мал волумен за зачувување. Избегнувајте повеќекратно замрзнување и одмрзнување или долгорочно крио-конзервирано 4 ° C.
Несоодветен дизајн на прајмери (на пр. Должината на прајмерот не е доволна, димер формиран помеѓу прајмерите итн.)
А-3 мг2+концентрација
■ Мег2+ концентрацијата е премногу ниска —— Правилно зголемување на Mg2+ концентрација: Оптимизирајте го Mg2+ концентрација со серија реакции од 1 mM до 3 mM со интервал од 0,5 mM за да се одреди оптималниот Mg2+ концентрација за секој образец и прајмер.
А-4 Температура на огревање
■ Високата температура на печење влијае врз врзувањето на прајмерот и шаблонот. - Намалете ја температурата на огнот и оптимизирајте ја состојбата со градиент од 2 ° C.
А-5 Време на продолжување
■ Кратко време на продолжување —— Зголемете го времето на продолжување.
Феномени: Негативните примероци исто така ги покажуваат опсезите на целната секвенца.
А-1 Контаминација на ПЦР
■ Вкрстена контаминација на целната секвенца или производи за засилување —— Внимателно да не го пипетирате примерокот што содржи целна секвенца во негативниот примерок или да не го истурите од цевката за центрифуга. Реагенсите или опремата треба да бидат автоклавирани за да се елиминираат постојните нуклеински киселини, а постоењето на контаминација треба да се утврди преку негативни контролни експерименти.
Контаминација со реагенс —— Активирајте ги реагенсите и чувајте ги на ниска температура.
А-2 премиерr
■ Мег2+ концентрацијата е премногу ниска —— Правилно зголемување на Mg2+ концентрација: Оптимизирајте го Mg2+ концентрација со серија реакции од 1 mM до 3 mM со интервал од 0,5 mM за да се одреди оптималниот Mg2+ концентрација за секој образец и прајмер.
Неправилен дизајн на прајмер, а целната секвенца има хомологија со нишантната секвенца. —— Редизајнирани буквари.
Феномени: Лентите за засилување на ПЦР се неконзистентни со очекуваната големина, големи или мали, или понекогаш се појавуваат и специфични појаси за засилување и неспецифични појаси.
А-1 Буквар
■ Лоша специфичност на прајмерот
--— Буквар за повторно дизајнирање.
Concentration Концентрацијата на прајмерот е премногу висока —— Правилно зголемување на температурата на денатурација и продолжување на времето на денатурација.
А-2 мг2+ концентрација
■ На Mg2+ концентрацијата е превисока —— Правилно намалете ја концентрацијата на Mg2+: Оптимизирајте го Mg2+ концентрација со серија реакции од 1 mM до 3 mM со интервал од 0,5 mM за да се одреди оптималниот Mg2+ концентрација за секој образец и прајмер.
А-3 Термостабилна полимераза
■ Прекумерна количина ензим —— Намалете ја количината на ензим соодветно во интервали од 0,5 У.
А-4 Температура на огревање
Temperature Температурата на загревање е премногу ниска-—соодветно зголемете ја температурата на огнување или усвојте го двостепениот метод на загревање
Циклуси А-5 ПЦР
■ Премногу PCR циклуси —— Намалете го бројот на PCR циклуси.
А-1 Буквар—— Лоша специфичност —— Редизајнирајте го прајмерот, сменете ја положбата и должината на прајмерот за да ја подобрите неговата специфичност; или изведете вгнездени ПЦР.
Шаблон ДНК А-2
- Шаблонот не е чист - Прочистете го образецот или извлечете ДНК со комплети за прочистување.
А-3 мг2+ концентрација
- —Мг2+ концентрацијата е превисока —— Правилно намалување на Mg2+ концентрација: Оптимизирајте го Mg2+ концентрација со серија реакции од 1 mM до 3 mM со интервал од 0,5 mM за да се одреди оптималниот Mg2+ концентрација за секој образец и прајмер.
А-4 dNTP
- Концентрацијата на dNTP е превисока - соодветно намалете ја концентрацијата на dNTP
А-5 Температура на огнување
—— Премногу ниска температура на огнување —— Соодветно зголемување на температурата на огнување
Циклуси А-6
—— Премногу циклуси —— Оптимизирајте го бројот на циклусот

Првиот чекор е да се избере соодветна полимераза. Редовната Taq полимераза не може да се лекторира поради недостаток на активност на 3'-5 'егзонуклеаза, а несовпаѓањето во голема мера ќе ја намали ефикасноста на продолжувањето на фрагментите. Затоа, редовната Taq полимераза не може ефикасно да ги засили целните фрагменти поголеми од 5 kb. Taq полимеразата со специјална модификација или друга полимераза со голема верност треба да се избере за да се подобри ефикасноста на продолжувањето и да се задоволат потребите за долго засилување на фрагменти. Покрај тоа, засилување на долги фрагменти, исто така, бара соодветно прилагодување на дизајнот на прајмер, време на денатурација, време на продолжување, тампон pH вредност, итн. Обично, прајмерите со 18-24 п.п. може да доведат до подобар принос. Со цел да се спречи оштетување на шаблонот, времето на денатурација на 94 ° C треба да се намали на 30 секунди или помалку по циклус, а времето за покачување на температурата на 94 ° C пред засилување треба да биде помало од 1 мин. Покрај тоа, поставувањето на температурата за продолжување на околу 68 ° C и дизајнирањето на времето на продолжување според стапката од 1 kb/min може да обезбеди ефикасно засилување на долги фрагменти.
Стапката на грешка при засилување на ПЦР може да се намали со употреба на разни ДНК полимерази со голема верност. Меѓу сите пронајдени досега полимерази на Taq DNA, Pfu ензимот има најниска стапка на грешка и најголема верност (видете ја приложената табела). Покрај селекцијата на ензими, истражувачите можат дополнително да ја намалат стапката на мутација на ПЦР со оптимизирање на условите на реакција, вклучувајќи оптимизирање на тампон составот, концентрација на термостабилна полимераза и оптимизирање на бројот на циклусот на ПЦР.
Категории на производи
ЗОШТО НЕ ИЗБЕРЕМЕ
Од своето основање, нашата фабрика развива производи од прва светска класа со почитување на принципот
со квалитет прво. Нашите производи се здобија со одлична репутација во индустријата и вредна доверба меѓу новите и старите клиенти.








